温馨提示:
下载整套试卷可直接点击附件!
![]() 湖北成人教育2023年成人高考高起点物理化学预测真题及答案(五).docx
湖北成人教育2023年成人高考高起点物理化学预测真题及答案(五).docx
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分150.考试时间120分钟.
选 择 题
一、选择题:本题共15小题,每小题4分,共60分.在每小题给出的四个选项中,只有一项是符合题目要求的.
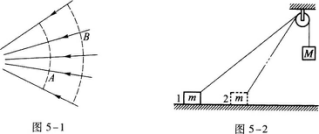
1·在电场线如图5-1所示的电场中,A和B两点的电场强度的大小分别为EA和EB,电势分别为UA和UB,则( )
A.EA >EB,UA>UB
B.EA >EB,UA < UB
C.EA<EB,UA < UB
D.EA <EB,UA > UB

2·如图5-2所示,质量为M的物体悬挂在细绳上,细绳跨过定滑轮,另一端系一质量为m的物体,m在水平地面上的位置1处保持静止,把m移至2处,仍保持静止,则在两个位置上( )
A.m所受的绳的拉力改变,地面的摩擦力不变
B.m所受的绳的拉力不变,地面的摩擦力减小
C.m所受的绳的拉力改变,地面的摩擦力减小
D.m所受的绳的拉力不变,地面的支持力不变
3·质点做初速度为ν0的匀加速直线运动,它的位移为s时,速度为ν1,则它位移为2s时,速度是( )
A.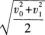
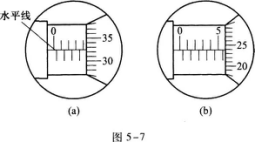
B.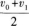
C.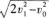
D.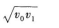
4·有人用图5—3所示的电路来测量电源的电动势拶和内电阻r,则测量的结果是( )
A.ξ不正确,r也不正确
B.ξ不正确,r正确
C.ξ正确,r不正确
D.ξ正确,r也正确
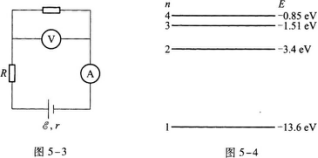
5.图5-4是氢原子能级图的一部分,大量原子被激发到n=3的能级上.由于电子的跃迁氢原子辐射的光谱有N条,光子的最大能量为E,由图可知( )
A.N=2,E=12.1 eV
B.N=3.E=10.2 eV
C.N=2,E=10.2 eV
D.N=3.E=12.1 eV
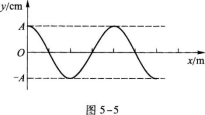
6.有一沿石轴正方向传播的简谐横波,某时刻的波形如图5-5所示.已知波速ν=300 m/s,频率f=300 Hz.在△t=0.02 s的时间内。波沿戈轴传播的距离为s,介质中位于原点O处的质点经过平衡位置的次数为n,则( )
A.x=6 m.n=6
B.s=12 m.n=6
C.x=6 m.n=12
D.s=12 m.n=12
7.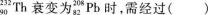
![]()
A.4次α衰变,6次β衰变
B.6次α衰变,4次β衰变
C.6次α衰变,8次β衰变
D.4次α衰变,8次β衰变
8.现有如下物质:①氨水;②干冰;③液态氯;④盐酸;⑤胆矾;⑥漂白粉;其中属于纯净物的是( )
A.①②③
B.②③⑤
C.②④⑤
D.①④⑥
9.用同一NaOH溶液,分别与相同体积的盐酸、醋酸溶液反应,完全反应后消耗了相同量的NaOH溶液.由此说明该盐酸和醋酸溶液的关系是( )
A.H+浓度相同
B.物质的量浓度相同
C.溶质的质量分数相同
D.pH相同
10.用500 mL 2 mol/L的NaOH溶液吸收0.8 mol的CO2气体,所得产物的化学式为( )
A.Na2CO3
B.NaHCO3
C.Na2CO3和NaHCO3
D.不能确定
11.下列说法中正确的是( )
A.Cl2有毒,Cl-也有毒
B.Cl2和Cl-都是黄绿色
C.Cl2既可作氧化剂,又可作还原剂
D.干燥的Cl2可使红色布条褪色
12.下列各组溶液中,各溶质的物质的量浓度相同,其pH符合由小到大顺序的是( )
A.KCl、HBr、HI
B.HCl、H2SO4、H3PO4
C.KOH、NaOH、Ca(OH)2
D.HCl、CH3COOH、NH3·H2O
13.下列各组离子能在水溶液中大量共存,并且溶液显酸性的是( )
A.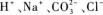
![]()
B.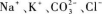
![]()
C.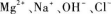
D.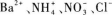
14.某短周期元素R,其原子核外最外电子层的电子数比次外电子层的电子数少4个,则其最高价含氧酸的分子式是( )
A.H2SiO3
B.H2CO3
C.H3PO4
D.HNO3
15.下列说法中正确的是( )
A.符合同一通式的各种有机物,一定互为同系物
B.在酯化反应中,羧酸分子脱去羟基,醇分子脱去羟基上的氢原子
C.凡是能发生银镜反应的有机物一定都是醛
D.苯和乙烯都能使酸性KMnO4溶液褪色
非选择题
二、填空题:16~19题每题6分,20~27题每空3分,共57分.把正确答案填在题中横线上.
16.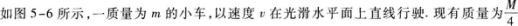
的重物,以水平速度2ν迎面投到车上,最后相对于车静止.车和重物共同运动的速度为 .在此过程中因摩擦所产生的热量是 .
17.氢原子的古典模型为一个电子绕着原子核中的质子做圆周运动.设质子不动,质子和电子的电荷大小为q,静电子常数为k,圆周半径为r,电子质量为m,则电子的动能Ek= ,电子运动的速度ν= (用q、k、r、m表示).
18.从离地面高10 m处以4 m/s的初速度水平抛出一个质量为0.2 kg的物体.不计空气的阻力,抛出后第1 s内重力做功为 J,第1s末重力的瞬时功率是 W.
19.在图5—7(a)中,螺旋测微器的读数是 ,在(b)中的读数是 .
20.2,5-二甲基-3-乙基庚烷的结构简式为 .
21.氯水中存在如下平衡:

向氯水中加入少量NaOH溶液,平衡 移动.
22.在下面的氧化还原反应中
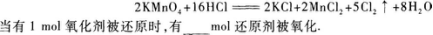
23.除去Na2CO3固体中混有的少量NaHCO3杂质,方便的方法是 .
24.某有机物的化学式为C3H4O2,它的水溶液显酸性,能与碳酸钠溶液反应,又能使溴水褪色,此有机物的结构简式为 .
25.有一种无色透明的溶液,其中含有KNO3、NH4Cl、Na2SO4、(NH4)2SO4、Na2CO3和(NH4)2CO36种中的一种或几种,实验方法和实验现象如下:
(1)取少许溶液进行焰色反应,透过蓝色钴玻璃观察,溶液的火焰呈浅紫色
(2)往溶液中加入少量NaOH溶液并加热,产生有刺激性气味的气体.
(3)往溶液中加入少量BaCl2溶液,生成白色沉淀,继续加入过量稀HNO3,白色沉淀全部溶解.
根据以上实验现象判断:该溶液中一定有 ;一定没有 .
26.元素X、Y、Z的原子序数都小于18.X元素原子的最外电子层上有5个电子,其最高价含氧酸是一种强酸.Z原子最外电子层比次外电子层少2个电子;Z与Y位于同一周期,它们相互作用可形成化合物Y2Z.X的元素符号为 ,Y的原子结构示意图为 ,化合物Y2Z的电子式为 .
27.在实验室内制取CO2、NH3、H2、CH4、Cl2、C2H46种气体时,需用图5—8所示装置制取的气体是 .
三、计算题:本题共3小题,共33分.解答时要求写出必要的文字说明、方程式和重要的演算步骤.只写出最后答案而未写出主要演算过程的,不能得分.
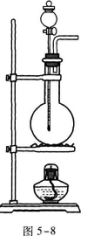
28.(本题11分)如图5—9所示,在高h=10 m的平台上,放一个质量m1=9.9 kg的木块,它与平台边缘的距离为l=1.0 m.今有一颗质量m2=0.1 kg的子弹以水平向右的速度ν0=500 m/s射人木块,并留在木块中.木块与平台间的摩擦因数μ=0.45,求:(取g=10 m/s2.)
(1)子弹射入木块过程中,木块所受冲量的大小;
(2)木块离开平台边缘时的速度;
(3)木块落地时与平台边缘的距离.

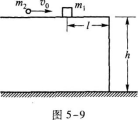
29.(本题12分)如图5-10所示,电阻R1=R2=R3=30 Q,电源内阻忽略不计.已知当开关S断开时,电阻R3的功率P3=30 w.求:
(1)通过电阻R1的电流;
(2)电源电动势ξ的大小;
(3)当S合上时R3的电功率.
30.(本题10分)将一定质量的Na2CO3和NaHCO3混合物加热灼烧至恒重,将放出的气体通入足量的Ca(OH)2饱和溶液中,充分反应后得到的沉淀的质量是1.0 g.加热后剩余的固体物质与足量盐酸反应,收集到1.12 L(标准状况下)气体.计算原固体混合物中Na2CO3与NaHCO3的物质的量之比.
参考答案及解题指要
选择题
一、选择题
1.【参考答案】 B
【解题指要】 本题的考点是电场线和等势面的基本概念.
电场线和等势面是形象化描绘电场的几何方法,电场强度用电场线描述,电势用等势面描绘.电场线上每点的切线方向表示该点电场强度的方向,在等势面上各点的电势相等,图中实线表示电场线,虚线表示等势面.图中B、A不在同一根电场线上.为了解题方便起见,把通过B的电场线与通过A的等势面的交点C标出,如图5—11所示.
关于电场线的重要结论是:电势沿电场线的方向降低.B、C在同一根电场线上,由上述结论知,UB>UC.C、A在同一等势面上,UC=UA,由此可见
UB>UC=UA
即UB>UA,排除A、D.
电场线不仅可以描述电场强度的方向,也可以表示电场强度的大小.电场线的疏密描述了电场强度的大小.电场线分布较密处电场强度较大,电场线分布较疏处电场强度较小.由图可见,A点附近的电场线较密,B点附近的电场线较疏,因此EA>EB,选B.
2.【参考答案】 B
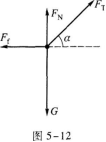
【解题指要】 这是一道有关在四个共点力作用下物体平衡的考题.解题的关键是正确地对 物体m进行受力分析,并画出受力图,再根据受力图写出平衡方程.
以物体m为研究对象,它受四个作用力:重力G、绳子拉力FT、静摩擦力Ff、地面支持力FN.受力图如图5—12所示.m在四个力作用下平衡,满足力的平衡条件.此外,M在绳拉力和重力作用下平衡,故有

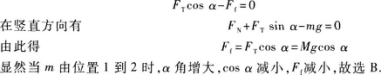
3.【参考答案】 C
【解题指要】 本题是初速度不为零的匀加速直线运动的试题.根据匀加速直线运动的速度一位移公式知,位移为s时的速度为
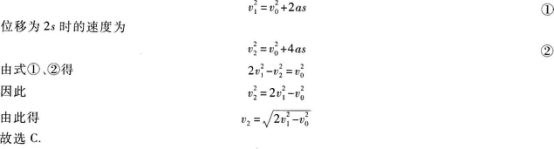
有些考生先由式①求出a,再代人式②求ν2.这样计算较复杂,容易失误.
4.【参考答案】 C
【解题指要】 本题是关于用伏安法测量电源电动势和内阻实验的试题.考查的知识点是电路中电流表和电压表的正确连接方法.在用伏安法测量电源电动势和内阻的实验中,电流表必须串联在电路中,用来测量通过电源的电流.电压表必须并联在电源上用来测量电源两端的路端电压.在图5-3中,电流表的接法是正确的,但电压表的接法不正确.由图知,电压表接在A和R的两端,它实际上测量的是电源与R串联后的电压(电流表A上的电压可忽略不计).因此,用这种电路测量的电阻实际上包含了外电阻R,不正确.
5.【参考答案】 D
【解题指要】 本题考查的知识点是氢原子的能级图和辐射光谱.由图5—3知处于n=3能级向低能级跃迁的方式是从n=3直接跃迁到n=2或n=1的能级,电子跃迁到n=2的能级后,还可以再跃迁到n=1的能级.相应于这三种跃迁方式有3根谱线即N=3,排除A、C.显然,n=3与n=1的两能级之间的距离最大,因此电子从n=3到n=1的跃迁过程辐射光子的能量最大,此能量为
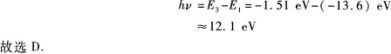
有些考生选N=2,这主要是没有考虑到电子从n=3跃迁到n=2后仍处于不稳定状态,还可以从n=2跃迁到n=1.此外,能级中的能量都是负的,在计算时负号不能漏去.
6.【参考答案】 C
【解题指要】 本题考查的知识点是简谐运动的过程、波速的概念、频率与周期的关系.波在△t时间内沿介质传播的距离为
s=v△t
代人题给数值得
s=300x0.2 m=6 m
据此排除B、D.波的频率和周期等于介质中质点做简谐振动的频率和周期.由频率与周期的倒数关系得波的周期为
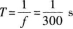
因此,在△t时间内,介质中质点做简谐振动的次数为

当质点做一次全振动时,先后往返两次经过平衡位置.因此,位于原点O处的质点在△t时间内经过平衡位置的次数是
n=2N=2x6=12
故选C。
当然,N也可由f直接求得.N=△t·f=0.02x300=6注意,备选项A具有迷惑性,考生较易误选.有些考生算出振动次数为6次后就直接选A.这也是审题欠慎造成的,题意求质点经过平衡位置的次数,并非求振动次数.质点做一次全振动时,两次通过平衡位置,一次通过振动的一个端点.
7.【参考答案】 B
【解题指要】 α衰变的核反应方程的一般形式是

8.【参考答案】B
【解题指要】 区别纯净物与混合物的依据是看有几种物质或说有几种分子(分子式),但结

9.【参考答案】B
【解题指要】 (1)首先应明确盐酸、醋酸溶液分别与NaOH溶液反应,消耗NaOH溶液的量与盐酸、醋酸溶液中所含溶质的量成正比.从反应方程式中可知它们的质量比和物质的量之比.
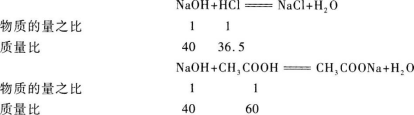

10.【参考答案】 C
【解题指要】 (1)首先要想到,NaOH溶液吸收CO2气体是碱与酸性氧化物反应,应生成盐和水.其次,根据题目给出的反应物的数量:500 mL 2 mol/L的NaOH溶液和0.8 mol CO2气体,应想到此题需定量计算.因NaOH与CO2反应时其数量比不同,所以反应产物也有所不同:

所以产物为Na2CO3和NaHCO3的混合物.
11.【参考答案】C
【解题指要】 (1)一般单质(原子或分子)的性质与组成单质的元素的离子的性质是不同的,如:Cl2呈黄绿色,Cl-则是无色;Cl2有毒,Cl-则无毒.
(2)氯气能使红色布条褪色,是因为氯气与水发生反应生成具有漂白作用的次氯酸(HCIO),所以干燥的氯气是不能使红色布条褪色的.
(3)非金属单质在反应过程中,化合价既能升高(显正价),又能降低(显负价).如:

所以,Cl2既能作氧化剂,又能作还原剂.
12.【参考答案】 D
【解题指要】 (1)pH由小到大的顺序就是酸性减弱、碱性增强的顺序.各组溶液中可以都是酸溶液或都是碱溶液,也可以是由酸溶液逐渐过渡到碱溶液.
(2)HCl、H2SO4都是强酸,但HCl为一元强酸,H2SO4为二元强酸,所以当酸的物质的量浓度相同时,H2SO4电离出的H+比HCl电离出的H+多1倍,即H2SO4溶液的酸性比HCl溶液强.所以B选项错误.
A选项中,KCl是强酸强碱盐,水溶液呈中性,而HBr、Hl溶液均呈强酸性,所以不符合酸性减弱的顺序.
C选项中,KOH、NaOH溶液为强碱性,Ca(OH)2是中强碱,溶液的碱性较弱,所以也不符合碱性增强的顺序.
D选项中,HCl溶液是强酸性,CH3COOH溶液是弱酸性,而NH3·H2O溶液是弱碱性,符合酸性减弱、碱性增强的顺序.
13.【参考答案】 D
【解题指要】 此题有两个要求:一是溶液中离子能大量共存,二是溶液显酸性.解题时可分别考虑.
(1)离子能否大量共存溶液中离子能大量共存,就是离子间不能发生化学反应.若离子间能发生化学反应,那么这些离子就不能在溶液中大量共存.离子间发生的化学反应一般指:生成沉淀的反应、生成气体的反应、生成弱电解质(弱酸、弱碱和水)的反应、强氧化性离子与强还原性离子之间的氧化还原反应.

B选项和D选项中的离子都可以大量共存.
(2)溶液显酸性溶液显酸性的原因,可以是含有大量H+,也可以是含有能发生水解反应生成H+的离子.

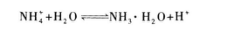
因水解反应生成H+而使溶液显酸性.所以D选项为正确选项.
14.【参考答案】 A
【解题指要】 (1)“原子核外最外电子层的电子数比次外电子层的电子数少4个”,此句话是本题的关键.
因短周期元素最多只有3个电子层,而此元素至少应有2个电子层——最外层和次外层,所以可能有以下两种情况:
①此元素原子只有2个电子层.因此时,次外层即第一层只有2个电子,所以最外层即第二层不可能比次外层(第一层)少4个电子.故此答案不合理.
②此元素原子有3个电子层.则第二电子层为次外层,其中应有8个电子,最外电子层即第三电子层的电子数为8-4=4个.
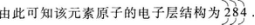
(2)根据上述原子的电子层结构,可知该元素位于元素周期表第三周期、第ⅣA族,元素符号为Si,元素名称是硅,最高正化合价为+4价,负化合价为-4价.由此可推知其最高价含氧酸的分子式是H2SiO3,即为A选项.
15.【参考答案】 B
【解题指要】 A选项错误.因同系物必须是结构相似,组成相差n个CH2原子团的一系列化合物.同系物符合同一个通式,但符合同一个通式的有机物不一定是同系物.如丙烯

c选项错误.凡是含有醛基的物质都能发生银镜反应,如葡萄糖、甲酸、甲酸的盐或甲酸的酯都可以发生银镜反应.因此应该说,银镜反应证明物质分子中一定含有醛基,但该物质不一定是醛.
D选项错误.乙烯可以使酸性KMnO4溶液褪色,但苯不能.总之,学习过程中在掌握一些重要概念、规律的同时,还要掌握一些实例或特例,尤其是例外的特例.
非选择题
二、填空题
16.【参考答案】0.4v 0.9mν2
【解题指要】 本题考查的基本规律是动量守恒定律以及能量守恒定律.
选择小车和重物为系统.在重物开始投到小车上到最后与小车以共同的速度运动的过程中,系统水平方向不受外力作用(小车在光滑的水平面上),所以系统水平方向的动量守恒.取小车的运动方向为正方向,则重物开始投到小车上时系统的初动量为

ν’的方向与ν相同,向右.
在重物与小车做相对运动的过程中,克服接触面间的摩擦力而损耗了系统的机械能.根据能量守恒定律,损失的机械能等于过程中产生的热量,因此

17.![]()
【解题指要】 本题是力学、电学综合题,有一定难度.考查的知识点有:氢原子模型、库仑定律、匀速圆周运动、向心力公式.
当电子绕原子核(质子)做匀速圆周运动时,电子所受质子的库仑引力就是它做匀速圆周运动的向心力.根据向心力公式有

18.【参考答案】9.6 19.2
【解题指要】 本题考查的知识点是平抛运动的概念和重力做功的计算.平抛运动在竖直方向的分运动是自由落体运动.重力做的功等于重力与物体下落高度的乘积.由自由落体运动的规律知,物体下落的高度为
![]()
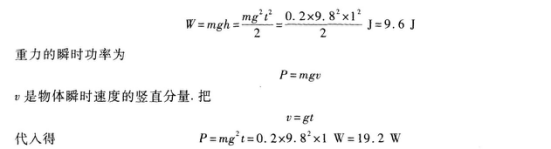
因此,重力做的功.
本题中重力做的功只与物体在竖直方向的分运动有关,因此题给条件中的抛出高度和水平速度等都是不必要的,起了迷惑考生的作用.
19.【参考答案】4.323 mm 5.738 mm
【解题指要】 本试题考查的知识点是螺旋测微器的读数.
在图5—7(a)中,螺旋测微器前沿在上刻度线的4 mm处,它尚未超过下刻度0.5 mm线,螺旋测微器的读数为32.3,因此(a)的读数为4 mm+32.3×0.01 mm=4.323 mm
在图5—7(b)中,螺旋测微器的前沿在上刻度线的5 mm处,并已超过了0.5 mm线,螺旋测微器上的读数为23.8,因此(b)的读数是5 mm+0.5 mm+23. 8x0.01 mm=5.738 mm
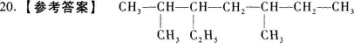
【解题指要】 本题给出了有机物的名称,要求写出其结构简式.
(1)首先,根据名称可知该有机物的母体是含有7个碳原子的直链烷烃——庚烷,其结构简式是:CH3一CH2一CH2一CH2一CH2一CH2一CH3.
(2)其次,可知该有机物有三个取代基,其中两个是甲基一CH3,分别连在2号碳原子和5号碳原子上;一个是乙基一C2H5(或一CH2一CH3),连在3号碳原子上.
21.【参考答案】 向右(或向正反应方向)
由于消耗了平衡反应中的生成物,即减少了生成物的浓度,根据平衡移动原理,可知平衡应向右移动.
22.【参考答案】 5
【解题指要】 根据题目给出的反应方程式
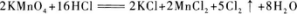
应得出以下结论:
(I)反应中的氧化剂是KMnO4,还原剂是HCl.
(2)反应中被还原的氧化剂是2 mol,但被氧化的还原剂却不是16 mol,而是10 mol.这是因为在参加反应的16 mol HCl中,作还原剂的(即被氧化的),也就是HCl中Cl元素化合价升高(从-1价升为0价)的只有10 mol,另外6 molHCl在此反应中化合价没有变化,即没有被氧化.
所以:当有2 mol氧化剂被还原时,有10 mol还原剂被氧化;当有1 mol氧化剂被还原时,有xmol还原剂被氧化.
 (成人高考更多完整资料免费提供加 微信/QQ:29838818)
(成人高考更多完整资料免费提供加 微信/QQ:29838818)
23.【参考答案】加热
【解题指要】 除杂质应采用不引入新杂质的方法,即不加其他试剂,而用溶解、过滤或加热等方法使杂质除去.此题是Na2CO3中含少量NaHCO3杂质,可用加热方法除去杂质.因为在加热时,Na2CO3不发生反应,只有NaHCO3发生分解反应:
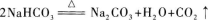
![]()
这样就把NaHCO3变成了Na2CO3而将杂质除去.
所以,作为除去杂质的一般方法是:加入的试剂只与杂质反应,不能与有效成分反应;与杂质反应后的生成物若不是有效成分.则应易与有效成分分离开来.
24.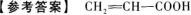
![]()
【解题指要】 (1)根据“水溶液呈酸性,能与碳酸钠反应”,可知该有机物分子中一定含有羧基(-COOH)(酚羟基虽然也有酸性,但酸性很弱,不能与Na2CO3反应,且从分子式C3H4O2来看,该有机物不可能是酚类).
(2)“能使溴水褪色”,说明分子中可能含有不饱和的碳碳双键或碳碳三键.根据分子式C3H4O2,去掉羧基(一COOH)后剩下的烃基为-C2H3,由此可知此烃基中一定含有碳碳双键,不能含有碳碳三键.
另外,分子中若含有醛基(一CHO)时,也可使溴水褪色,但前面已说明该有机物分子中一定是含有羧基(一COOH),根据已给出的分子式C3H4O2,可确定不可能再含有醛基.

25.
【解题指要】 解答这类题目,首先应对各种物质或各种离子的特殊反应或鉴别方法非常熟悉.其次,从方法上来说,应根据实验现象说明未知物中一定含有什么物质、一定不含有什么物质.

反应方程式为
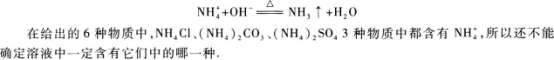




三、计算题
28.【参考答案】 (1)子弹与木块做完全非弹性碰撞,动量守恒.设子弹进入木块后一起运动的速度为ν,则由动量守恒得m2ν0=(m2+m1)ν于是有

(2)碰撞后木块(含子弹)在平台摩擦力作用下做匀减速直线运动.根据牛顿第二定律


【解题指要】 本试题是力学的综合计算题,它包含的知识点有:完全非弹性碰撞、动量守恒、动量定理、牛顿第二定律、匀减速直线运动、平抛运动等.全过程包含三个分过程:完全非弹性碰撞、匀减速直线运动和平抛运动.
解题时应当根据木块运动的过程,按次序一步步地进行,不能操之过急.确定三个分过程之间的联系:木块碰撞后的速度是它做匀减速直线运动的初速度,木块匀减速运动的末速度是它做平抛运动的初速度.再确定各个过程中涉及的主要规律:在第一个分过程中是动量守恒和动量定理,在第二个过程中是牛顿定律和匀减速直线运动的公式,在第三个分过程中是平抛运动的公式.
29.【参考答案】 (1)当S断开时,外电路是R2、R3并联后再与R1串联的混联电路.

(3)当开关S闭合时,电路中的外电路是R2、R3的并联电路,所以外电阻为R23,因此电路的总电流为
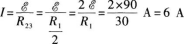

【解题指要】 本题是有关电路计算的试题,考查的知识点是:闭合电路的欧姆定律、欧姆定律和电功率等.解题的关键是弄清外电路中电阻的连接方式.特别要注意的是当开关s闭合后,电阻R1被短接,不起作用,外电路是R2、R3的并联电路.
此外,本题的解题过程是先求出支路电流I3再求得总电流I和电源电动势ξ.这与一般的电路习题中的解题步骤有所不同.这主要是因为题中未给出电源电动势,ξ是待求量.本题忽略电源的内阻r.如果考虑了电源内阻r,怎样求ξ?考生不妨思考一下.
30.【参考答案】

答:混合物中Na2CO3与NaHCO3的物质的量之比为2:1.
【解题指要】 (1)解此题用关系式法比较简便,可以减少计算步骤.
(2)因在混合物加热时,只有NaHCO3发生反应,放出CO2,而Na2CO3不发生反应,放出的CO2与Ca(OH)2反应生成沉淀CaCO3,所以可根据生成的沉淀(CaCO3)的量直接求得NaHCO3的物质的量.
(3)由于NaHCO3受热分解生成Na2CO3,所以与盐酸反应的Na2CO3应包括原固体混合物中含有的和NaHCO3分解后生成的两部分,这一点很关键.根据反应生成的CO2的量可求得Na2CO3的总量,又知NaHCO3的量已求出,故其生成的Na2CO3的量也可求得,二者之差即是混合物中Na2CO3的物质的量.






